搜索


近日,国际权威期刊Journal of the American Chemical Society(JACS)在线发表了题为“Glycan-Modified Cellular Nanosponges for Enhanced Treatment of Cholera Toxin-Induced Secretory Diarrhea”的研究论文,williamhill官网博士生韩田振为第一作者,艾相昭长聘教轨副教授、李荣秀教授和杨广宇研究员为共同通讯作者。

霍乱是一种由革兰氏阴性霍乱弧菌引起的严重传染病,全球每年约有300万感染病例,患者通常在数小时内出现严重的分泌性腹泻,导致低血压休克和死亡。霍乱弧菌根据其外膜脂多糖的O抗原可分为200多个血清群(O1- O200),因此具有非常复杂的病原多样性。然而,目前的临床方案仍然不足以有效治疗霍乱感染。例如,口服补液是治疗霍乱的标准方案,其通过补充大量液体和盐分来缓解患者的严重脱水,但无法抑制霍乱弧菌的感染过程。抗生素能够减轻霍乱弧菌引起的腹泻症状,但起效时间较晚且无法快速缓解脱水,同时抗生素大量使用也可能导致出现耐药的超级霍乱菌株。霍乱疫苗有望预防霍乱弧菌的感染,但由于O抗原的多样性,目前的霍乱疫苗预防效果均不理想,而开发多价广谱的霍乱疫苗仍然存在巨大挑战。因此,亟待开发新策略来有效应对霍乱弧菌引起的霍乱疫情。
在霍乱弧菌定植小肠的过程中,会大量分泌一种外毒素蛋白,称为霍乱毒素(cholera toxin),这是引起霍乱的主要毒力因子之一。霍乱毒素具有AB5型蛋白结构,由一个A亚基和五个相同的B亚基组成。在感染过程中,B亚基首先与小肠上皮细胞膜上多种糖萼受体结合,这是其感染宿主细胞最关键的第一步。内吞进入细胞后,霍乱毒素通过逆行转运途径进入内质网管腔,并将A亚基释放在细胞质中,其能够通过ADP核糖基化来激活腺苷酸环化酶,提高细胞内环磷酸腺苷(cAMP)的浓度,从而过度激活小肠上皮细胞表面关键的阴离子通道蛋白(囊性纤维化跨膜传导调节蛋白,CFTR)。该过程最终导致大量氯离子(Cl-)过度分泌到肠腔内,引起肠液的电解质失衡,使大量水分从肠粘膜下层渗透到肠腔,最终造成严重的急性水样腹泻和危及生命的并发症。
受到霍乱毒素入侵宿主细胞过程的启发,我们设计了一种糖萼受体功能化的小肠上皮细胞膜仿生纳米诱饵(Glyco-INS),用于口服治疗霍乱毒素引起的分泌性腹泻。首先,我们提取小肠上皮细胞的细胞膜,将其包覆在可生物降解的聚乳酸-羟基乙酸(PLGA)纳米核心上,并在细胞膜表面嵌入糖脂分子(富含唾液酸的神经节苷脂)来构建Glyco-INS,其尺寸约为160 nm,且完整保留了小肠上皮细胞的所有膜蛋白成分。在霍乱毒素入侵宿主细胞实验中,Glyco-INS能够有效捕获霍乱毒素(94%),从而抑制小肠上皮细胞内cAMP浓度的升高。同时,我们将一种强效CFTR抑制剂(PPQ-102, IC50 ~90 nM)装载到Glyco-INS的PLGA核心中(Glyco-INS-P),通过胃肠道微环境响应的精准药物控释,有效阻断霍乱毒素感染的宿主细胞内Cl-离子的过度外排,实现了“内外兼顾”的协同治疗。在霍乱毒素引起的小鼠腹泻模型中,口服Glyco-INS-P能够有效减少小鼠的腹泻肠液体积、炎症因子表达和和肠道组织损伤,并恢复到健康小鼠的水平。更重要的是,Glyco-INS天然继承了宿主细胞膜上全部的靶蛋白和糖萼受体,有望广谱性中和多种具有复杂结构和致病机制的细菌外毒素,从而为治疗不同致病菌引起的腹泻相关疾病提供了广谱应对方案,具有潜在的临床应用前景。
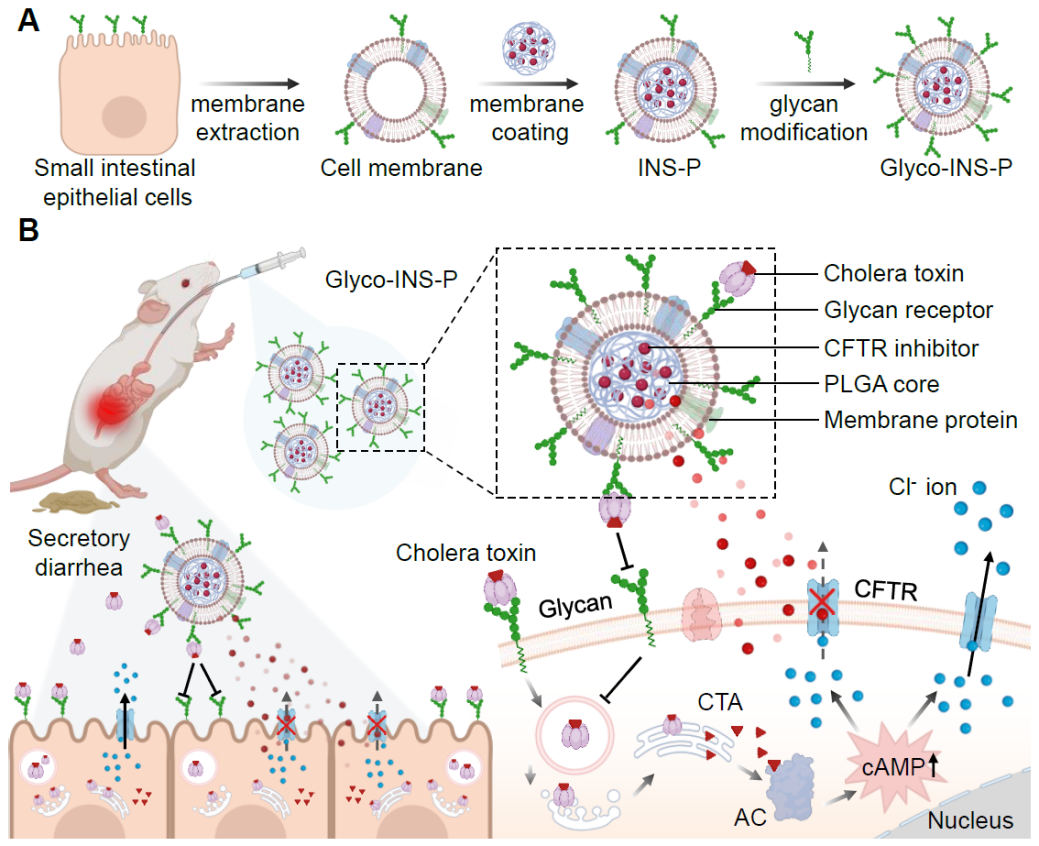
图1.(A)糖萼功能化的小肠上皮细胞膜仿生纳米药物(Glyco-INS-P)制备过程示意图;
(B)口服Glyco-INS-P后在小鼠模型中有效治疗霍乱毒素引起分泌性腹泻的潜在机制。
艾相昭课题组聚焦细胞膜仿生纳米药物递送和肿瘤疫苗开发的研究领域,取得了一系列研究成果。该工作得到了国家自然科学基金(32271437、52202180、32371483)和上海市科技重大专项的资助。
论文链接:https://pubs.acs.org/doi/full/10.1021/jacs.5c00955


 首页
首页

 WilliamHill概况
WilliamHill概况

 师资队伍
师资队伍

 人才培养
人才培养

 招生就业
招生就业

 科学研究
科学研究

 平台基地
平台基地

 党群工作
党群工作

 校友之家
校友之家

 安全工作
安全工作

 网上办事
网上办事

 当前位置:
当前位置: